В течении последнего времени в России уделяется существенное внимание вопросам в области воспроизводства стада и повышения уровня племенных качеств животных, так как это является краеугольным камнем в отечественном животноводстве. Однако успешное решение данных вопросов невозможно без использования современных методов и технологий, которые уже давно нашли свое применение в странах Запада.
Получение эмбрионов крупного рогатого скота методом in vitro - современный и прогрессивный биотехнологический метод, позволяющий значительно ускорить процесс воспроизводства высокопродуктивных животных. Данный метод состоит из нескольких этапов: извлечение ооцитов из антральных фолликулов яичника (OPU), созревания ооцитов (IVM – in vitro maturation); оплодотворения (IVF – in vitro fertilization) и эмбриональной культуры (IVC – in vitro culture). Важным аспектом данной технологии является то, что получать яйцеклетки от животных доноров можно как прижизненно, используя метод трансвагинальной аспирации, так и от убойного материала (яичники коров с мясокомбината). Получение разделённых по полу эмбрионов - востребованный и перспективный метод, который заключается в оплодотворении яйцеклеток сексированной спермой быков. Оплодотворение яйцеклеток разделённой по полу спермой в отличие от обычной даёт возможность получать особей желательного пола с вероятностью до 93 %. Помимо возможностей в области селекции данный метод имеет и ряд экономических преимуществ, а именно: при пересадке эмбрионов, не разделённых по полу, частота рождения бычков составляет до 55%. Что имеет немаловажное значение в молочном скотоводстве, где есть большая потребность в ремонтных тёлочках с высокой молочной продуктивностью.
Исходя из этого перед коллективом лаборатории ООО «Бетагран- Липецк» была поставлена задача направленная на создание оптимального протокола оплодотворения и культивирования доимплонтированных эмбрионов in vitro. Для этого ооциткумулюсные комплексы получали прижизненно из антарльных фолликулов диаметром 2-6 мм от коров доноров методом TAU (транс вагинальной аспирации. После чего ооциткумулюсные комплексы помещались в среду дюльбекко с добавлением с 5% эстральной сыворотки, 4% р-ра гентамицина и р-ра. гепарина. Поиск и морфологическую оценку осуществляли на стереомикроскопе лабораторного класса, Olympus SZ51 при 200 кратном увеличении. Для экспериментов отбирали ооциты средней величины с мелкозернистой ооплазмой, окруженные компактным многослойным кумулюсом. Для дозревания ооцитов использовали среду 199 (Medium 199, Hepes modification, 25mM.) с добавлением 10% эстральной сыворотки крови крупного рогатого скота, Na-пирувата, BSA, 1.0 ЕД / мл лютенизирующего гормона, 10 ME/мл, фолликулостимулирующего гормона, 1,0мкг / мл эстрадиола (спиртовой раствор) и 50 мкг / мл гентамицина.
Ооциты помещали в лунки планшетов в среду созревания в объёмом 500 мкл под минеральным маслом (“Sigma”, США) и культивировали в течение 20-24 часов при температуре 38,5-39 в атмосфере 5 % CO2 в воздухе. Для оплодотворения использовали разделённое по полу криоконсервированное семя быков в пайэтах объёмом 0,25 мл из расчёта 1 доза на 30 яйцеклеток. Оттаивание производили при температуре + 37 º С в течении 40 секунд. По той же схеме оттаивалось и обычное семя быков. Получение подвижной фракции сперматозоидов проводили путём центрифугирования в градиенте плотности (р-р перколла) при оборотах ротора центрифуги 300G. Выход подвижных сперматозоидов при центрифугировании в градиенте плотности был больше, чем при использовании метода флотации (Swim Up). Для оплодотворения яйцеклетки перемещались в лунки со средой Fert-TALP объёмом 80 мкл. И инкубировались совместно со сперматозоидами в течении 18-20 часов при температуре 38,5-39 в атмосфере с содержанием 5 % CO2.
После оплодотворения зиготы отмывали в растворе SOF и механически удаляли клетки кумулюса посредством пепетирования при помощи наконечников для денудации ооцитов диаметром 135 мкм. Очищенные зиготы помещались в среду на основе SOF c добавлением BSA, MEM vitamins, MEM Niaa, MEM iaa в лунки планшетов объёмом 500 мкл, покрытые минеральным маслом ( Sigma ,США) и культивировали при температуре 38,5º С в увлажненной атмосфере под газовой фазой (по 5% CO2 и O 2 и 90 % N2) в течение 7-8 суток. Количество оплодотворённых зигот подсчитывали через 48 и 62 часа после оплодотворения.
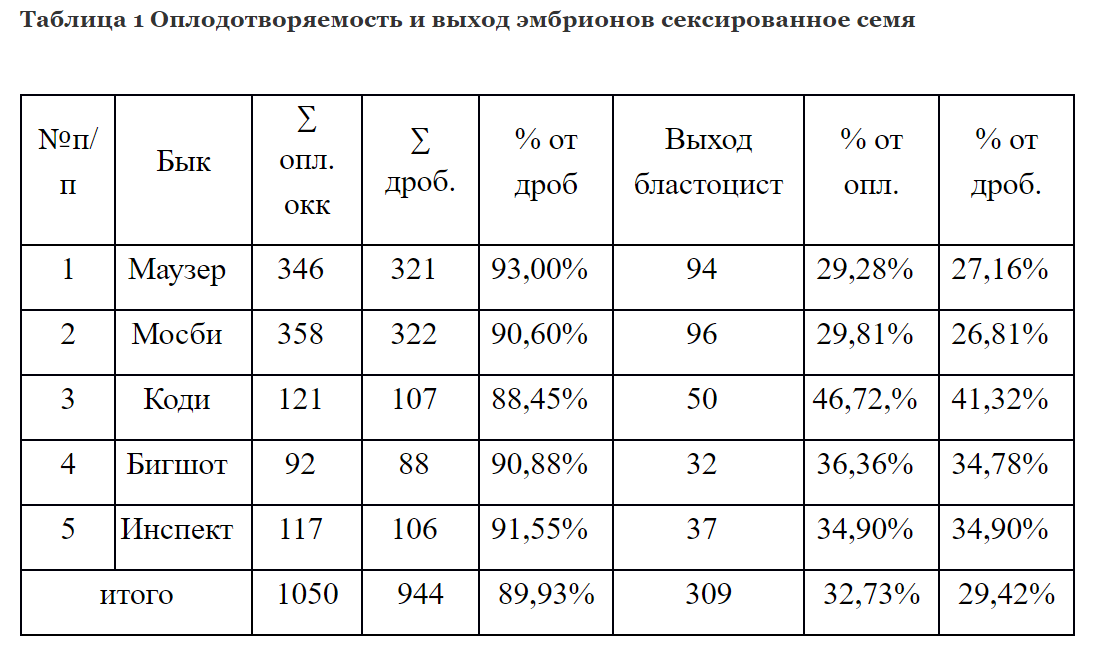
Для определения эффективности оплодотворения сексированной спермы использовалось заморожено-оттаянное семя пяти быков. Было оплодотворено 1050 яйцеклеток, полученных методом OPU. Из них у 944 началось дробление, средний процент дробящихся яйцеклеток составил 89,93%. Выход доимплонтированных бластоцист от числа поставленных на созревание яйцеклеток составил 29,42%
Во втором случае использовалось обычное заморожено-оттаянное семя от четырёх быков. Было оплодотворено 770 яйцеклеток, полученных методом OPU. Из них у 708 началось дробление, средний процент дробящихся яйцеклеток составил 91,94%. Выход доимплонтированных бластоцист от числа поставленных на созревание яйцеклеток составил 35,58%
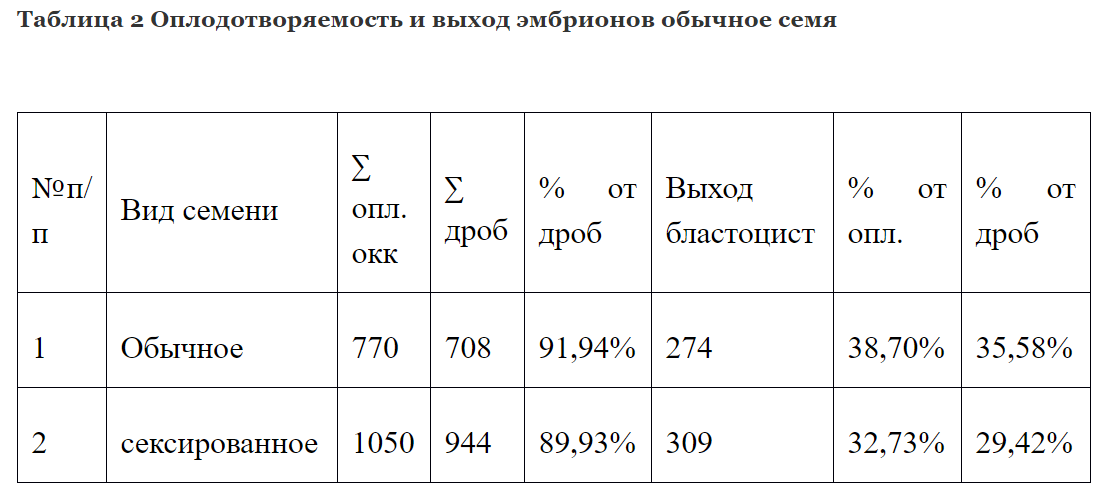
Таким образом сравнивая вышеперечисленные данные, можно сделать вывод, что оплодотворяющая способность сексированного и традиционного семени не имеет значительных расхождений.
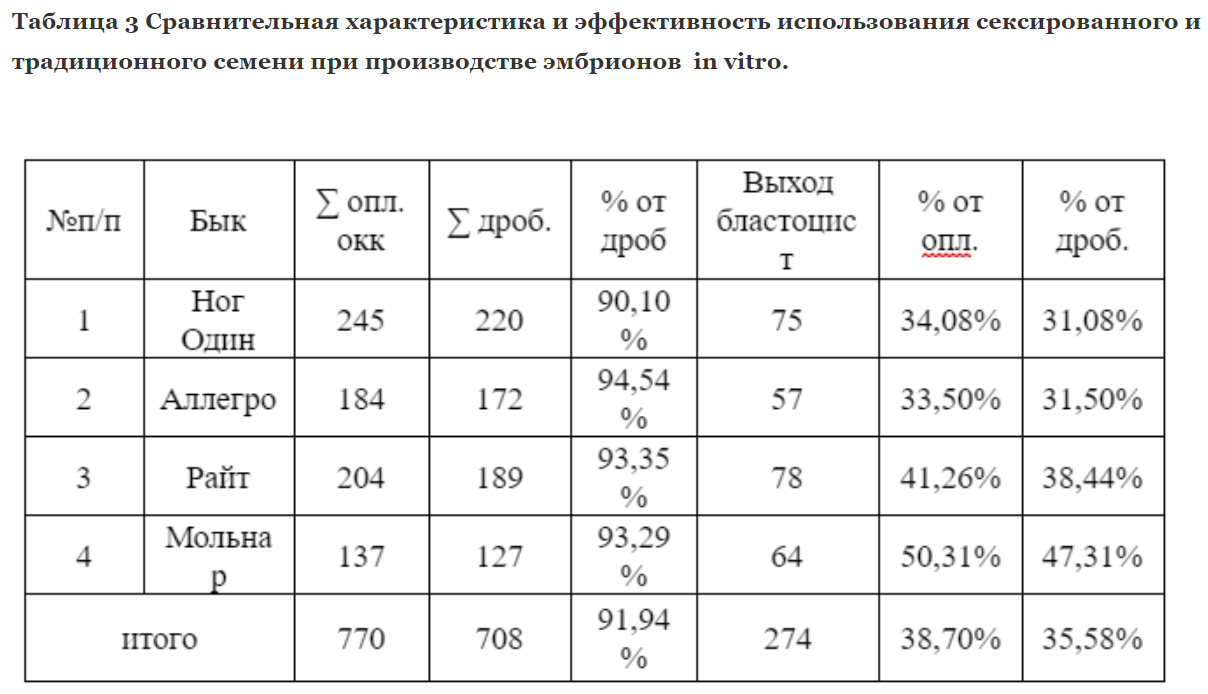
Так разница составила 2,01% в пользу обычного семени. Выход эмбрионов был больше на 6,16 в пользу обычного семени. Несмотря на то, что культивирование эмбрионов производилось на одной культуральной системе, количество полученных эмбрионов in vitro было выше в группе, где использовалось обычное семя. Мы предполагаем, что это связанно с окрашиванием сперматозоидов флуоресцентной краской, из-за чего снижается энергетический запас, что и может обуславливать меньший жизненный потенциал гамет по сравнению с обычным семенем, как следствие - остановку развития некоторых эмбрионов.
Таким образом, наши данные свидетельствуют о том, что разработанный протокол оплодотворения и культуральная система обладает высоким потенциалом и позволяет получать в массовом количестве разделённые по полу эмбрионы по технологии in vitro. А так же может использоваться для получения, зигот и предимплантационных эмбрионов КРС in vitro для различных биотехнологических программ.
Автор: Дмитрий Машталер
Источник: dairynews.ru